大脑由神经元组成,不过我们的运动和感知通常并非来自单个神经元,而是来自大脑中许多神经元的集体行为。从单个神经元,到局部的神经元群体,再到大尺度的脑网络,要如何跨越多个尺度,从数学上刻画神经元的集体动力学?2017年发表于 Nature Neuroscience 的综述文章「大尺度脑活动的动力学模型」,从偏物理角度系统总结了宏观大脑皮层尺度的建模工作。论文作者 Michael Breakspear 是大尺度脑动力学建模的大神级人物,研究涉猎广泛。今天的文章是对这篇综述的概览介绍。
研究领域:神经元集体活动,系综理论,复杂网络
彭崧峻 | 作者
梁金 | 审校
邓一雪 | 编辑
论文题目:
Dynamic models of large-scale brain activity
论文链接:
https://www.nature.com/articles/nn.4497
虽然对单神经元的动作电位计算特性的研究已经取得了很大进展,但是运动和感知通常不是来自单个神经元,而是来自大脑系统中许多皮层、丘脑和脊髓神经元的集体行为[1]。宏观功能成像数据,如脑功能性磁共振成像(fMRI)和脑电图成像(EEG)反映了成千上万神经元的集体活动[2]。到目前为止,还没有广泛接受的神经元群体的集体活动的数学理论。
在磁学、流体动力学、生态学等许多学科中,观察到的现象反映的是集体行为,而不是单个单元的行为。这些领域的研究是建立在精确的数学定律基础上的,这些定律控制着诸如磁场、流体流动和人口动态等宏观变量[3]。
事实上,在神经科学领域存在平均场模型[4],不是描述单个脉冲神经元的行为,而是描述神经元群体的集体行为[5]。它们在模拟癫痫、静息态脑网络等诸多宏观活动上取得了进展,并成为多模态数据融合的工具[6]。模型反演技术的进步(根据经验数据估计模型的参数)使平均场模型在认知神经科学中得到广泛应用[7]。
然而,大规模大脑活动的动态模型渗透到主流神经科学一直缓慢。其中一些原因是技术上的:测试这些模型的预测具有挑战性。其他的原因可能是历史和文化方面的:神经科学研究历来以对单个神经元的非常详细的描述而自豪。
集体神经元活动的模型对于理解知觉和行为以及大规模神经影像数据的决定因素是至关重要的。这些模型也有它们技术上(限制了它们的即时效用)和概念上(限制了它们的最终效用) 的注意事项。这篇综述介绍了大规模脑活动的动态模型,从基本理论的原则到挑战、争论和最近的突破。
单神经元的膜电位变化是高度非线性的,但是这种非线性是否出现在宏观神经元集体活动中?如果是的话,又是什么过程“传输”了跨尺度的非线性动力学[8]?最能描述这种集体动力学的方程的合适形式是什么?有许多方法可以解决这些问题。
-
神经元系综方法
解决这个问题的最简单的方法是假设在大的空间尺度上,单个神经元的状态是彼此不相关的,而且,整个神经元群的神经元状态是互不相关的。
中心极限定理表示不相关的随机变量之和收敛于高斯概率分布,即使个别过程是高度非高斯的。根据这个扩散近似(diffusion approximation),由高度非线性但基本上不相关的动作电位组成的神经元系综活动,可以简化为一个标准正态分布,具有简单的线性统计。这样,一个神经元系综(比如一个皮层区域)的活动可以由发放率的均值和方差两个变量来描述,平均发放率反映了神经元群体对总输入的响应,而方差则反映了随机效应的离散程度。
描述这种线性正态分布系综的动力学方程叫做 Fokker–Planck方程(FPE)。在扩散近似成立的假设下,一个神经元系综的 FPE 可以从简单的整合发放(integrate-and-fire)神经元模型解析地导出[9]。
平均发放率实质上是所有神经元响应的被动总和,并编码其输入的平均(最可能的)总体表示。FPE 还描述了总体方差的动力学,对应于总体响应的表征精度[10]。作为系综变化的输入,FPE 捕捉系综活动的漂移(平均值的变化)和扩散(方差的变化)。
FPE 是局域神经元群体编码的一种可解析实现的表征。神经元的非线性,神经元之间的局域相关性和神经元类型之间的差异,都被扩散近似所包含。FPE将脉冲神经元群体的成千上万个自由度简化为均值、方差两个变量,这种维度简化是超越“大脑暴力解释(即超大规模神经元网络)”的核心[11]。
正态分布是均值和方差固定时,熵最大的分布,从信息论的视角,FPE是一个神经元系统包含信息最少(潜在信息最多)的表征。因此,线性 FPE 可以看作是神经系统大尺度模型的起点。当统计量服从其它简单的概率分布(如幂律分布)时,存在定义良好且易于处理的(非线性或分数阶) FPE。随机场理论可以适应这些良好行为的非高斯场景。因此,这些更一般的 FPE 对于具有强相关性和重尾统计特性的神经系统系综建模是非常有用的。然而,尽管这是理论物理学中的一个活跃领域,但在神经科学中却是一个相对未被探索的领域。
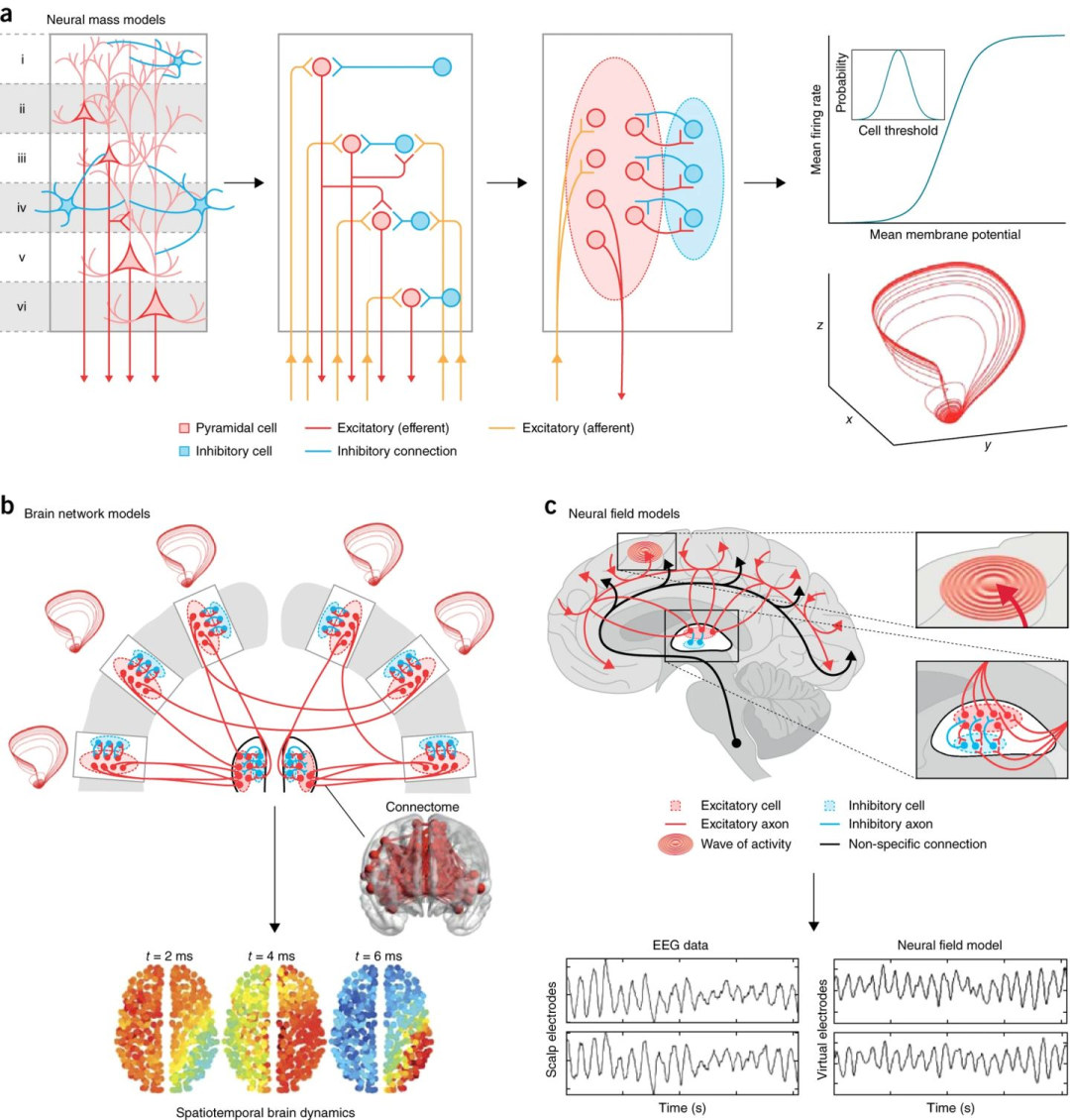
图1:神经元系综简化的原理。(a) 复杂的空间系统,例如人类皮层柱,由随着距离减弱的相互作用耦合在一起的组分构成。(b) 如果由此产生的相关性与系统的大小相比衰减得很快,系统的统计数据会收敛到一个正态分布(内嵌图) ,即使个别组成部分的统计数据是高度非高斯的。(c) Fokker–Planck方程描述了随机涨落的输入和强度发生变化时统计量是如何相应变化的。在这里,随着输入增加,噪音变得不那么有影响力。当我们沿着箭头方向移动时,平均发放率上升,总体分布变得更加精确。(d) 如果系统内的相关性变强——例如,由于同步——相关长度在箭头指向蓝曲线的方向上向系统大小发散。作为扩散近似基础的假设可能不能得到满足。(e) 如果存在强烈的系综相关,统计数字可能会收敛到一个非高斯分布(蓝曲线)。典型的波动向平均值收缩(因此分布变得更像帐篷) ,但是左右尾(极端值)变得更胖,相应的是罕见但高振幅的同步波动。
-
神经群体模型
在存在强相关的情况下,可以合理地假设系综活动足够接近平均值,从而可以丢弃方差。这将维度的数量减少到一个,使得多个相互作用的局域群体,如在不同皮层的兴奋性和抑制性神经元群体,可以由较小数量的方程组模拟,每个方程描述一个神经元群体的平均活动[12]。这种群体作用方法是神经群体模型(Neural mass models, NMMs)的核心。
神经群体模型有几种风格。其中一类假设神经元之间的相关性是如此之强,以至于整个神经元系综的动力学类似于单个神经元的动力学。相应地,系综平均活动模型采用与单神经元模型相同的基于电导的模型。模型使用sigmoid类型的激活函数,将膜电位映射为平均发放率。sigmoid函数的宽度隐含地包含了神经元阈值和神经元状态的散布[13]。这种NMM与FPE的核心区别在于,NMM中方差是固定值,而FPE建模了方差的演化。这种NMM通常包含兴奋性神经元(有电导)和抑制性神经元(通常是被动的)的耦合,可以呈现稳态、周期性和混沌振荡(通过快慢时间尺度的混合)。
第二类神经群体模型是采用 Hodgkin 和 Huxley 的方法,通过细致的经验观察来理解模拟系统对输入的响应(唯象理论)。与Hodgkin-Huxley模型类似,早期的NMM是从仔细观察神经群体(兔子嗅球)对驱动输入变化的集体反应中得出的[14]。这类方法尊重这样的理念:复杂系统可以在不同的组织层次上展示具体的规则,因此大尺度的活动可能不仅是其各部分的总和。Wilson–Cowan模型[15]和Jansen-Rit模型[12]是这类经验模型的典型例子。还有一些混合方法将群体动力学的理论处理与经验性的突触和输入-响应函数结合起来[16]。
-
神经群体的网络
神经群体模型(NMM)描述了一个局部群体的相互作用的神经元,如锥体神经元和抑制神经元。但局域群体和支持大脑功能的大规模系统之间仍然存在几个尺度的差距。通过将一系列NMM耦合到介观和宏观环路,可以搭建起大尺度的脑动力学模型[17]。每个神经元群体节点(即每个 NMM)内的动力学反映了局部群体活动加上来自远端区域(其他节点)和随机波动的影响。这种大规模的脑网络模型(Brain Network Models, BNMs)是一个多尺度的系综,在不同尺度上有不同的组织规则。
将 NMM 耦合成更大的系统需要依靠解剖连接,即连接组。在动物模型上,侵入式的纤维追踪构建了细致的连接组[18]。对于人脑,DTI 成像(diffusion tensor imaging, 一种特殊的核磁共振成像技术)可以提供解剖连接。由此得到的全脑动力学模型在局部NMM、节点间的传导时延、混沌或随机动力学的选择上各有不同[19]。这是一个强有力的方法,将数十年来有关 NMM 的工作与复杂脑网络的研究结合起来[20]。脑网络模型在静息态 fMRI 数据中的应用是一个非常活跃的领域,我们将在下面进行回顾。
-
神经场模型
脑网络模型将大脑皮层视为通过连接体耦合的动态节点组成的离散网络。但是在宏观尺度上,皮层也可以被视为一个由密集的短程连接组成的连续薄片,这些短程连接随着区域间距迅速(指数)减少。大尺度神经模型将大脑皮层视为一个连续的片状结构ーー神经场模型(Neural Field Models, NFMs)ーー借鉴了其他复杂系统中成熟的场模型,并在计算神经科学中有着丰富的历史。
神经场模型中,最一般的公式使用微分方程(用于处理时间)和积分(用于处理空间耦合和时间延迟)的组合。对于考虑生物真实性假设的突触核(synaptic kernel, 局域连接的印记),可以将其建模为波动方程[21]。
神经场模型对很多问题都提供了见解,常用来解释波形的数据[22]。全脑神经电场模型的激发模式ーー捕获系统大部分能量的少量时空模式ーー与典型的静息态网络显示出惊人的匹配[23]。
将脑网络模型和神经场模型整合到一个单一的框架中是一个活跃的研究领域,旨在调和这些大规模脑模型明显相互矛盾的方面[24]。
图2:大尺度脑动力学模型。
(a) 神经群体模型(NMMs)通过对一个局域神经元群体,图中的一个皮层柱(左)中每一类神经元(锥体,抑制)的平均状态的建模来描述神经元群体行为。传统的脉冲神经模型将每个神经元视为一个理想化的单元(中心)。NMMs 更进一步,将整个群体的动态简化到低维微分方程,代表局部相互作用的神经元群的平均状态(右)。细胞阈值的变化(插图,右上角)将每个神经元的全有或全无动作电位平滑成介于平均膜电位和平均发放率之间的平滑的sigmoid函数。积分这个方程产生一个吸引子的局部动态(右下);
(b) 大脑网络模型(BNMs)是将一组NMMs耦合到一个大尺度系统(上) ,通过连接组进行连接。由于强大的短程连接,BNMs 可以产生波模式(底部)。这个例子展示了一个沿对角线方向向右移动的波。
(c) 在神经场模型(NFM)中,皮层被看作是一个平滑的平面(顶部),支持波动的传播(顶部插图)。包含丘脑神经群体的神经场模型(下图插图)产生 α 振荡,其光谱特性与经验数据中观察到的相同(下图)[25]。
-
检验、比较与驳斥模型
对大尺度神经活动模型的推断依赖于有效的观测模型。神经模型预测潜在的神经状态(发放率、膜电位等),这些状态并不直接可测。生成EEG模拟数据需要生物电磁模型,而生成fMRI模拟数据需要血流动力学模型。通过各自的前馈模型实现多种数据流的预测,这种方法也允许多模态数据的融合,如同时获得的 EEG 和 fMRI [6]。
模型的具体预测还取决于其参数的选择:增益、输入、耦合强度和噪声等。手工进行微调通常是不切实际的,而且容易造成过度拟合; 也就是说,得到可迁移性很差的复杂参数组合。从技术上讲,模型预测取决于参数的选择。可以在贝叶斯框架内集成这种依赖关系,该框架允许在给定模型参数值的可能(先验)分布的情况下估计模型预测的概率。通过引入惩罚模型复杂性的术语,可以通过反演估计特定模型的似然函数。不同的模型,包含了关于大脑的不同假设,可以根据它们的似然函数进行比较和排序。
这种贝叶斯方法现在已经在动态因果模型的框架内为脑磁图、脑电图和功能磁共振成像数据建立了良好的基础[26, 27]。虽然动态因果建模依赖于上述的平均场假设,它已经被最广泛地应用于简单的、线性稳定的 NMMs。系统估计的最新进展促进了它在诸如分岔和多稳定等非线性现象中的应用。
图3:NMMs和NFMs的经验验证的技术与概念框架。
(a) 大尺度动力学模型是从详细的神经生理学抽象出来的。数学分析和数值模拟的结合可以用来理解这些模型所支持的涌现动力学。这一步骤可以通过确保神经生理学参数被限制在现实值范围内来约束。然后需要一个前馈模型(生物磁性或血液动力学; 后者举例说明)从这些模型中预测经验数据。(b) 利用脑成像技术进行的经验性实验产生了一系列空间和时间分辨率的经验数据。可以同时获得高质量的功能磁共振成像和脑电图以检验模型预测。从神经模型到经验数据相当于模型预测。利用变分格式和适当的模型复杂度惩罚,预测和观测之间的不匹配可用于模型反演和比较[28]。
-
全脑动力学
大尺度模型目前最活跃的用途是为大尺度脑成像数据的动态变化提供候选机制[29]。这些机制的不同取决于所分析数据的性质(脑电图、脑磁图或功能磁共振成像)和所使用模型的细节。大多数模型都会引发某种形式的不稳定性,如多稳态[30]、亚稳态的混沌吸引子[31]和极限环[32]、幽灵吸引子(ghost attractor)[33]等。
脑电非线性动力学的历史也为这种努力提供了警示。首先,时间序列数据中的线性相关性会在时间窗口统计中引起(虚假的)波动,关于时间分辨的功能连通性的推论应该建立在适当地使用零假设检验的基础上[34]。其次,“动态的”这个术语应该指的是产生数据的神经元过程而不是观察到的数据本身: 将功能连接中的非平凡的波动称为“时间分辨的”或“非平稳的”而不是“动态的”功能连接更有原则性。关于生成数据的动态过程的推断,理想情况下应该参考通过模型反转恢复的模型[26]。第三,如上所述,许多动态不稳定机制被用来解释这些非平稳性,多稳态只是能够产生复杂动力学的许多动态场景之一。临界性出现在分岔的尖端,产生重尾波动(幂律) ,是另一个rs-fMRI数据的波动相关的候选过程[35], 亚稳态是指系统没有稳定的吸引子,而是包含一系列不稳定的鞍点,同样在考虑范围[36]。虽然这些术语经常可以互换使用,但每个术语都来自不同的机制,有独特的系综统计量,应注意仔细量化大尺度脑活动的统计数据,以便区分这些机制[37]。
-
临床应用
动态情景的广度为动态脑模型的临床应用提供了巨大的机会。我们已经看到癫痫发作是如何在NFMs和NMMs中被模拟为分叉的。最近的模型包括发作前的低频神经生理过程(漂移) ,提供了快速发作动力学和缓慢代谢过程之间的关系的洞察力[38]。这种见解为治疗干预提供了机会,包括利用闭环反馈控制癫痫发作,以减少与健康的静息状态吸引子之间的区别。
在临床神经生理学数据中应用 NMMs 和 NFMs 代表了一个丰富的领域,在许多其他神经系统疾病,从帕金森氏症到痴呆症等方面的应用正在兴起。在动态因果建模的框架内,网络中的扰动动态也被报道在精神病条件下,将精神分裂症定位为“联系障碍”综合症是这种方法的一个自然目标[39]。精神分裂症中皮质和额丘脑系统的动态连接障碍已被报道[40]。重度抑郁症患者的忧郁症特征表现为关键的注意力网络和内感网络之间的动态失调[41]。以动态机制为基础的疾病分类学在这个正在寻找比症状群更有原则的方法的领域具有相当大的概念吸引力[42]。
除了对成像数据的动态模型进行反演之外,大尺度神经模型可能在计算精神病学中发挥另一种作用[42]。包含均值和方差(即Fokker–Planck方程)的群体模型可以解释大脑皮层如何(通过其均值)对其表征值进行编码,以及(通过状态方差)这些表征的精确性。通过与精确加权编码的链接,Fokker–Planck方程代表了神经活动的生物物理模型和认知功能的贝叶斯解释之间的候选链接[43]。非线性系统理论增加了对大脑大尺度系统之间动态相互作用的见解[44]。
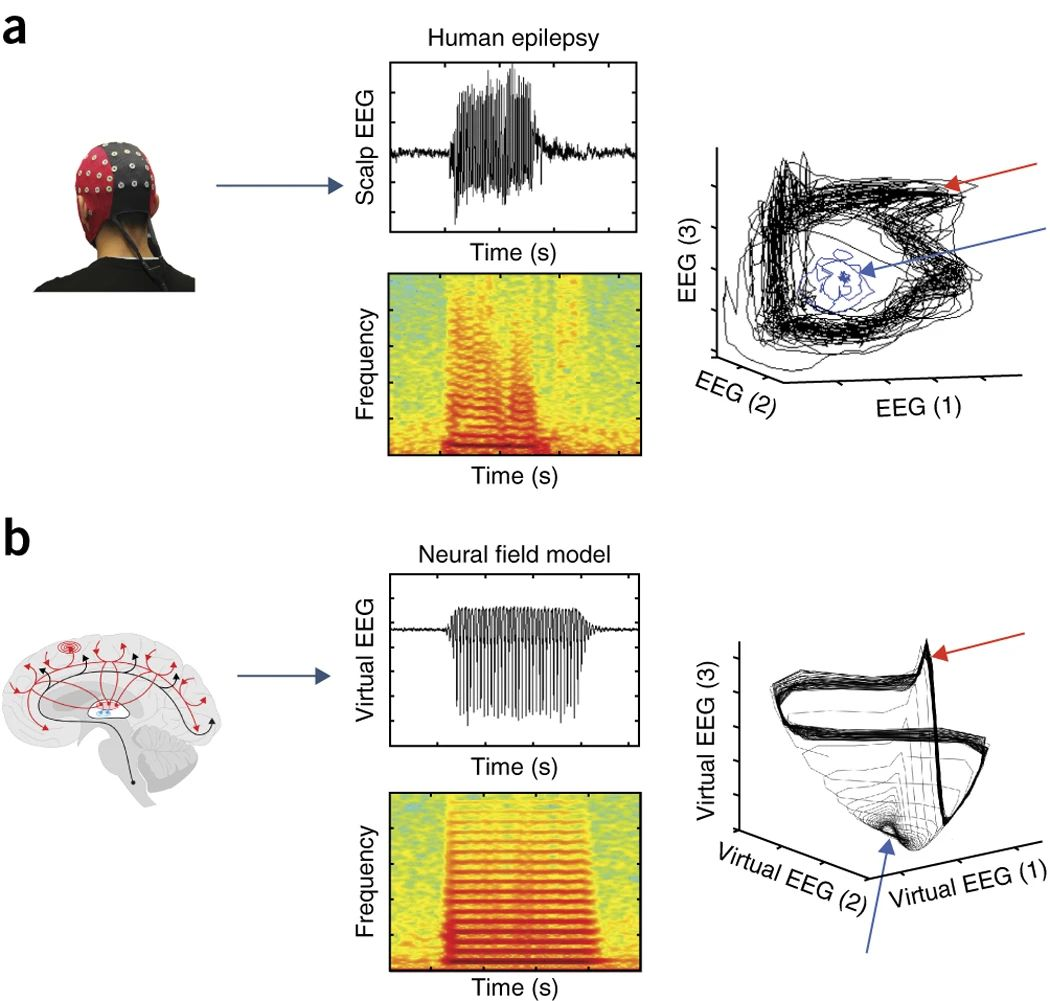
图4:神经场模型应用于癫痫研究。
(a) 人类头皮脑电图记录显示特征性的3 Hz失神发作。声谱图显示了基频3 Hz以及高次谐波,反映了非线性时间序列的特性。相空间重构(右)显示轨道从不动点(固定点,蓝色箭头)吸引子到高振幅复杂极限环(红色箭头)的快速发散。(b) 左侧,通过3 Hz 霍普夫分岔摄动的皮质丘脑神经场模型与 a (中间)的经验数据显示惊人的匹配,包括整体对称的癫痫发作形态,起始和偏移时的尖峰和波形,以及波谱图。右侧,癫痫发作的开始表现为通过分岔将非线性不稳定性引入神经模型后,轨道从不动点(蓝色箭头)到极限环(红色箭头)的发散[25]。
大尺度神经动力学模型在解释、预测和整合宏观的感知、行为和功能成像数据的神经活动方面是独一无二的。这些模型的概念基础越来越多地得到经验数据分析的支持。通过将不同的经验发现整合到一个可以反复精炼(或者驳斥)的统一框架中,动力学模型也可以帮助解决神经科学中的“再现性危机”。这些论点表明,大尺度脑活动模型在理解健康和疾病的功能成像数据的神经起源(如振荡和网络动力学)方面的作用日益重要。
大脑动力学模型的进一步发展可能正好出现在他们目前所依赖的假设被打破的地方。我们勾勒出允许神经元动力学的平均场近似的两个相反的情景: 当系统规模的相关性足够弱,个别动作电位可以忽略(得到Fokker–Planck方程) ,反之,当相关性足够强,方差可以被认为是小的常数(得到电导为基础的 NMMs)。来自各种神经元记录的一致的证据表明,许多神经元群体的统计数据可能是无标度的[45]。这样的系统拒绝平均场简化(因为方差是无界的) ,并且可能需要备选的系综模型[46]。未来的大规模大脑活动模型可能需要灵活性,以适应所有三种情况:弱相关性、强相关性和介于这些极端情况之间的无标度波动。
一个大胆的预测是,神经科学最终将由一个综合的非线性模型来锚定,该模型将认知和成像数据融合在一个框架中[10]。因此,研究将在包括受过必要的数学和物理培训的科学家在内的多学科小组中进行。要实现这一目标还有很长的路要走,包括更深入地理解复杂系统中集体行为的涨落。处于动态模型中心的维度简化是一个方便的但是现象学的工具,还是一个被大脑用来促进其适应动态环境的核心过程,这仍然有待观察。对该领域更近的预测包括验证一系列相关模型,这些模型的目标是“低垂的果实”: 癫痫发作的预测和控制,决策实验的设计和分析,以及对精神病分类系统的贡献[17]。要实现这些近处的目标,需要在实验设计和随后的数据分析中更多地使用计算模型。
1. Hoel, E.P., L. Albantakis, and G. Tononi, Quantifying causal emergence shows that macro can beat micro. Proc Natl Acad Sci U S A, 2013. 110(49): p. 19790-5.
2. Nunez, P.L. and R. Srinivasan, Electric fields of the brain: the neurophysics of EEG. 2006: Oxford University Press, USA.
3. Haken, H., Synergetics. Physics Bulletin, 1977. 28(9): p. 412.
4. Jirsa, V.K. and H. Haken, Field Theory of Electromagnetic Brain Activity. Phys Rev Lett, 1996. 77(5): p. 960-963.
5. Freeman, W.J., Mass action in the nervous system. Vol. 2004. 1975: Citeseer.
6. Valdes-Sosa, P.A., et al., Model driven EEG/fMRI fusion of brain oscillations. Hum Brain Mapp, 2009. 30(9): p. 2701-21.
7. Daunizeau, J., K.E. Stephan, and K.J. Friston, Stochastic dynamic causal modelling of fMRI data: should we care about neural noise? Neuroimage, 2012. 62(1): p. 464-81.
8. Anderson, P.W., More Is Different. Science, 1972. 177(4047): p. 393-396.
9. Deco, G., et al., The dynamic brain: from spiking neurons to neural masses and cortical fields. PLoS Comput Biol, 2008. 4(8): p. e1000092.
10. Friston, K., The free-energy principle: a unified brain theory? Nat Rev Neurosci, 2010. 11(2): p. 127-38.
11. Huys, Q.J., T.V. Maia, and M.J. Frank, Computational psychiatry as a bridge from neuroscience to clinical applications. Nat Neurosci, 2016. 19(3): p. 404-13.
12. Jansen, B.H. and V.G. Rit, Electroencephalogram and visual evoked potential generation in a mathematical model of coupled cortical columns. Biol Cybern, 1995. 73(4): p. 357-66.
13. Marreiros, A.C., et al., Population dynamics: variance and the sigmoid activation function. Neuroimage, 2008. 42(1): p. 147-57.
14. Freeman, W.J., Nonlinear gain mediating cortical stimulus-response relations. Biol Cybern, 1979. 33(4): p. 237-47.
15. Wilson, H.R. and J.D. Cowan, Excitatory and inhibitory interactions in localized populations of model neurons. Biophys J, 1972. 12(1): p. 1-24.
16. Miller, P., et al., A recurrent network model of somatosensory parametric working memory in the prefrontal cortex. Cereb Cortex, 2003. 13(11): p. 1208-18.
17. Wong, K.F. and X.J. Wang, A recurrent network mechanism of time integration in perceptual decisions. J Neurosci, 2006. 26(4): p. 1314-28.
18. Horvat, S., et al., Spatial Embedding and Wiring Cost Constrain the Functional Layout of the Cortical Network of Rodents and Primates. PLoS Biol, 2016. 14(7): p. e1002512.
19. Woolrich, M.W. and K.E. Stephan, Biophysical network models and the human connectome. Neuroimage, 2013. 80: p. 330-8.
20. Jirsa, V.K., et al., Towards the virtual brain: network modeling of the intact and the damaged brain. Arch Ital Biol, 2010. 148(3): p. 189-205.
21. Coombes, S., et al., Modeling electrocortical activity through improved local approximations of integral neural field equations. Phys Rev E Stat Nonlin Soft Matter Phys, 2007. 76(5 Pt 1): p. 051901.
22. Muller, L., et al., The stimulus-evoked population response in visual cortex of awake monkey is a propagating wave. Nat Commun, 2014. 5: p. 3675.
23. Robinson, P.A., et al., Eigenmodes of brain activity: Neural field theory predictions and comparison with experiment. Neuroimage, 2016. 142: p. 79-98.
24. Byrne, A., D. Avitabile, and S. Coombes, Next-generation neural field model: The evolution of synchrony within patterns and waves. Phys Rev E, 2019. 99(1-1): p. 012313.
25. Breakspear, M., et al., A unifying explanation of primary generalized seizures through nonlinear brain modeling and bifurcation analysis. Cereb Cortex, 2006. 16(9): p. 1296-313.
26. Friston, K.J., L. Harrison, and W. Penny, Dynamic causal modelling. Neuroimage, 2003. 19(4): p. 1273-302.
27. Stephan, K.E., et al., Nonlinear dynamic causal models for fMRI. Neuroimage, 2008. 42(2): p. 649-62.
28. Aquino, K.M., et al., Hemodynamic traveling waves in human visual cortex. PLoS Comput Biol, 2012. 8(3): p. e1002435.
29. Hansen, E.C., et al., Functional connectivity dynamics: modeling the switching behavior of the resting state. Neuroimage, 2015. 105: p. 525-35.
30. Freyer, F., et al., Biophysical mechanisms of multistability in resting-state cortical rhythms. J Neurosci, 2011. 31(17): p. 6353-61.
31. Zalesky, A., et al., Time-resolved resting-state brain networks. Proc Natl Acad Sci U S A, 2014. 111(28): p. 10341-6.
32. Gollo, L.L. and M. Breakspear, The frustrated brain: from dynamics on motifs to communities and networks. Philos Trans R Soc Lond B Biol Sci, 2014. 369(1653).
33. Deco, G. and V.K. Jirsa, Ongoing cortical activity at rest: criticality, multistability, and ghost attractors. J Neurosci, 2012. 32(10): p. 3366-75.
34. Prichard, D. and J. Theiler, Generating surrogate data for time series with several simultaneously measured variables. Phys Rev Lett, 1994. 73(7): p. 951-954.
35. Haimovici, A., et al., Brain organization into resting state networks emerges at criticality on a model of the human connectome. Phys Rev Lett, 2013. 110(17): p. 178101.
36. Cabral, J., M.L. Kringelbach, and G. Deco, Exploring the network dynamics underlying brain activity during rest. Prog Neurobiol, 2014. 114: p. 102-31.
37. Roberts, J.A., T.W. Boonstra, and M. Breakspear, The heavy tail of the human brain. Curr Opin Neurobiol, 2015. 31: p. 164-72.
38. Jirsa, V.K., et al., The Virtual Epileptic Patient: Individualized whole-brain models of epilepsy spread. Neuroimage, 2017. 145(Pt B): p. 377-388.
39. Stephan, K.E., K.J. Friston, and C.D. Frith, Dysconnection in schizophrenia: from abnormal synaptic plasticity to failures of self-monitoring. Schizophr Bull, 2009. 35(3): p. 509-27.
40. Wagner, G., et al., Structural and functional dysconnectivity of the fronto-thalamic system in schizophrenia: a DCM-DTI study. Cortex, 2015. 66: p. 35-45.
41. Hyett, M.P., et al., Disrupted effective connectivity of cortical systems supporting attention and interoception in melancholia. JAMA Psychiatry, 2015. 72(4): p. 350-8.
42. Stephan, K.E., et al., Translational Perspectives for Computational Neuroimaging. Neuron, 2015. 87(4): p. 716-32.
43. Stephan, K.E., et al., Charting the landscape of priority problems in psychiatry, part 2: pathogenesis and aetiology. Lancet Psychiatry, 2016. 3(1): p. 84-90.
44. Murray, J.D., et al., Linking microcircuit dysfunction to cognitive impairment: effects of disinhibition associated with schizophrenia in a cortical working memory model. Cereb Cortex, 2014. 24(4): p. 859-72.
45. Eguiluz, V.M., et al., Scale-free brain functional networks. Phys Rev Lett, 2005. 94(1): p. 018102.
46. Levina, A., J.M. Herrmann, and T. Geisel, Dynamical synapses causing self-organized criticality in neural networks. Nature Physics, 2007. 3(12): p. 857-860.
关于综述文章的更详细梳理介绍和参考文献,推荐参考路径文章:
https://pattern.swarma.org/article/169
随着电生理学、网络建模、机器学习、统计物理、类脑计算等多种技术方法的发展,我们对大脑神经元相互作用机理与连接机制,对意识、语言、情绪、记忆、社交等功能的认识逐渐深入,大脑复杂系统的谜底正在被揭开。为了促进神经科学、系统科学、计算机科学等领域研究者的交流合作,我们发起了【神经动力学模型读书会】。
集智俱乐部读书会是面向广大科研工作者的系列论文研读活动,其目的是共同深入学习探讨某个科学议题,激发科研灵感,促进科研合作。【神经动力学模型读书会】由集智俱乐部和天桥脑科学研究院联合发起,已于3月19日开始,每周六下午14:00-16:00(或每周五晚上19:00-21:00,根据实际情况调整)进行,预计持续10-12周。期间将围绕神经网络多尺度建模及其在脑疾病、脑认知方面的应用进行研讨。
详情请见:
神经动力学模型读书会启动:整合计算神经科学的多学科方法
点击“阅读原文”,报名读书会